Pour des soucis de compréhension et pour ne pas surcharger le schéma (déjà bien complexe), seules les voies métaboliques principales (nécessaires à l’explication de la pathologie) seront exposées.
Certaines données ne sont donc que partiellement exactes.
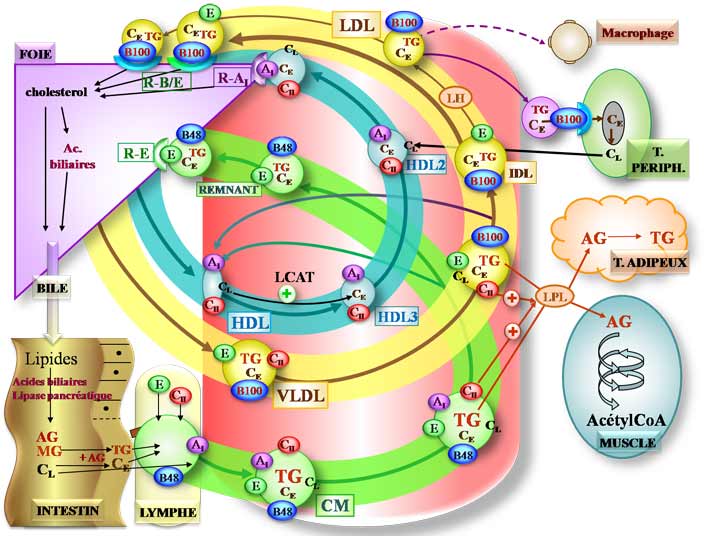
AG = acide gras MG = monoglycéride TG = triglycéride CL = cholestérol libre CE = cholestérol estérifié |
PL = phospholipide CM = chylomicron VLDL = very low density lipoprotein IDL = intermediary density lipoprotein LDL = low density lipoprotein |
HDL = high density lipoprotein LPL = lipoprotéine lipase LH = lipase hépatique |
Sous l’action des enzymes pancréatiques et en présence d’acides biliaires, les lipides sont dégradés en AG, MG, CL et PL qui pénètrent dans les entérocytes.
Dans les entérocytes, les AG et les MG sont réestérifié en TG et le CL est estérifié en CE.
Les entérocytes synthétisent des lipoprotéines : les chylomicrons qui sont surtout riches en TG et qui possèdent à leur surface principalement 2 apoprotéines : l’apo B48 et l’apoAI. Le passage lymphatique des CM leur permet de capter l’apo E et l’apo CII.
Des lipoprotéines lipases sont synthétisés par le muscle et par le tissu adipeux, sont sécrétés dans le sang et se fixent au niveau de la paroi de l’endothélium. Au passage des CM, l’apo CII (cofacteur des LPL) stimule la LPL qui hydrolyse les TG en AG + glycérol.
Les AG pénètrent
- dans le muscle pour être oxydés (cycle de Lynen) et donner des acétylCoA qui pourront par l’intermédiaire du cycle de Krebs donner de l’ATP.
- dans le tissu adipeux où ils seront stockés sous forme de TG
L’hydrolyse des TG des CM provoque une modification de structure de la lipoprotéine qui se scinde en remnant (contenant des TG, du CE, l’apo E et l’apo B48) et en HDL discoïdes (contenant du CL, des PL, de l’apo CII et de l’apo AI)
Les remnants vont se fixer au foie par des récepteurs à l’apoE. Dans le foie, des lipases hépatiques vont dégrader les TG en AG qui serviront principalement à la resynthèse de nouveaux TG ou à fournir des acétylCoA. Le cholestérol servira principalement à la synthèse d’acides biliaires ou sera éliminé dans la bile.
Le foie est le principal lieu de synthèse du cholestérol et des TG. Afin de faire parvenir ces lipides aux tissus périphériques, il synthétise des lipoprotéine les VLDL (riches en TG, CE, apo E, apo CII et apo B100) qui sont sécrétés dans le sang. De la même façon que les chylomicrons, au passage dans les capillaires des tissus musculaires et adipeux, l’apo CII stimule la LPL qui hydrolyse les TG en AG qui fourniront de l’énergie pour le muscle et seront stockés dans le tissu adipeux.
Comme les chylomicrons, les VLDL se restructurent en IDL (qui contiennent de l’apo E, apo B100, du CE et des TG) et en HDL (apo AI, apo CII, CL, PL). La majorité des IDL sont captés par le foie par des récepteurs capables de reconnaître l’apo E et l’apo B (ces récepteurs sont distincts des récepteurs captant les remnants). La fraction restante perd sont apo E et est hydrolysée par la lipase hépatique (libre dans le sang) qui libère des AG et du glycérol à partir des TG et forme des LDL (plus petite et relativement plus riche en CE et ne possédant plus que l’apo B100).
Ces LDL sont captés par les tissus périphériques et par le foie grâce aux récepteurs à l’apo B100 et libèrent leur cholestérol.
Certains LDL sont oxydés, ils ne peuvent plus être reconnu par les récepteurs à l’apo B100 et sont alors capté par les macrophages (récepteurs éboueurs (scavenger)) qui se transforment en cellules spumeuses et sont à la base de l’athérosclérose.
Les HDL ont 2 origines : synthèse hépatique et produit du métabolisme des CM et des VLDL. Ils sont riches en apo AI, apo CII (apo E pour ceux d’origine hépatique), en CL et PL. Dans le sang, un enzyme, la LCAT (lécithine cholestérol acyl transférase) estérifie le CL en CE qui devient totalement hydrophobe et pénètre au centre du HDL laissant ainsi de la place en périphérie pour capter du CL : les HDL deviennent des HDL3 sphériques. Les HDL 3 peuvent alors capter le cholestérol en excès au niveau des tissus périphérique (il deviennent des HDL 2) et le ramener au foie en se fixant sur les récepteurs à l’apo AI.